ARTÍCULO DE REVISIÓN
Infecciones en cirugía herniaria bioprotésica
Prosthetic infections in hernia surgery
Dr. Eduardo José Molina Fernández, Dr. Orlando de la Paz Mora, Dr. Leonardo Arias Larios, Dr. Juan Carlos García Sierra, Dr. Yoel Tamayo Gandol
Hospital Clínico Quirúrgico Comandante Manuel Fajardo. La Habana, Cuba.
RESUMEN
La reparación herniaria con material protésico ha reducido significativamente las tasas de recidiva, convirtiendo su uso en un estándar que goza de amplia aceptación. La infección de la malla es la mayor y más grave complicación en este tipo de cirugía, cuyo manejo se torna complejo requiriendo incluso a veces la extracción de la malla. Se realizó una revisión bibliográfica y se tuvo en cuenta la la experiencia personal de los autores, para abordar el manejo de este tipo de complicaciones. La infección de la malla es una complicación que necesita un manejo abarcador e intensivo que incluye desde el control local de la infección, el uso de antibiótico, y en ocasiones, la remoción parcial o total del implante.
Palabras clave: hernia, infección, malla, remoción.
ABSTRACT
Hernia repair using prosthetic meshes has dramatically reduced recurrence rates, so its use has been widely accepted. Mesh infections are the major complication in this type of surgery. Its management is usually complex and requires sometimes removal of the mesh. A literature review was made, taking into account the personal experience of the authors in addressing this type of complications. Mesh infection is a complication that requires comprehensive intensive treatment, going from the control of local infection, the use of antibiotics to the partial or total removal of the mesh graft if necessary.
Keywords: hernia, infection, mesh, mesh, removal.
INTRODUCCIÓN
Las hernias abdominales son uno de los principales motivos de consulta dentro de la cirugía general, cada año se realizan en el mundo miles de procedimientos para su corrección y múltiples técnicas han visto la luz en las últimas décadas, diseñadas para su tratamiento definitivo. La aparición de las bioprótesis junto con los novedosos conceptos fisiopatológicos han revolucionado su manejo de forma significativa.
Desde los estudios iniciales de Lichtenstein, Rives y Stoppa hasta llegar a las modernas técnicas endoscópicas, han demostrado las ventajas y superioridad de la cirugía herniaria bioprotésica (CHBP) sobre las reparaciones tisulares, sus niveles casi nulos de recidiva son uno de sus principales beneficios, pero no está exenta de complicaciones.1,2 Estas complicaciones deben ser estudiadas con más profundidad, así como sus factores de riesgo, frecuencia y sobre todo, cómo abordarlas con éxito, para desde una amplia perspectiva, hacer un uso seguro de los biomateriales sin renunciar a sus excelentes beneficios.
En el estudio de estas y debido a la elevada frecuencia con que se realizan las disímiles técnicas protésicas y su extensión por todo el mundo, se hace muy difícil obtener información confiable sobre la verdadera tasa de incidencia. Solo países como Dinamarca y Suecia han publicado recientemente los registros nacionales de hernia donde informan sobre las complicaciones asociadas a este tipo de cirugía, pero concentradas primariamente en la recidiva herniaria y en la frecuencia del dolor posoperatorio,3,4 sin abordar específicamente las complicaciones derivadas del bioimplante. De forma general en la actualidad este tipo de información solo se puede encontrar de manera aislada en los reportes periódicos de la literatura médica, en la que la mayoría de los autores informan un promedio dentro del porcentaje de complicaciones del 5-10 %.5-9
Aunque las complicaciones derivadas del uso de las bioprótesis infelizmente no siempre son totalmente evitables, se hace necesario conocer las posibilidades de que estas aparezcan, sus factores desencadenantes y las posibles causas para lograr reducir su incidencia. Igualmente conocer las diferentes modalidades de tratamiento para resolverlas.
Una de las complicaciones más temidas de la CHBP, por su repercusión, es la infección de las prótesis, cuyo tratamiento aún es diverso y en ocasiones no efectivo, lo cual impide el éxito de este tipo de proceder. A continuación hacemos un acercamiento a este tema mediante la revisión de la literatura internacional y la exposición de nuestra experiencia.
Principales factores a tener en cuenta
Frecuentemente las infecciones de las bioprótesis están relacionadas con cincos aspectos fundamentales:
- Factores de riesgo de los pacientes.
- Condiciones locales y generales.
- Composición y diseño de la bioprótesis.
- Manejo y almacenamiento del bioimplante.
- Técnica utilizada.
- Ambiente epidemiológico.
La relación que existe entre el uso de bioimplantes y la infección en la cirugía herniaria, es un tema latente que está sobre la mesa de trabajo de todo cirujano que emplea este tipo de material. Su manejo alcanza una gran connotación desde el concepto mismo, ya que para muchos cirujanos, higienistas y epidemiólogos la tasa de infección quirúrgica en cirugías limpias habla de la calidad de la técnica quirúrgica y las condiciones de higiene de un servicio de cirugía.10-12 A pesar de que la CHBP es considerada por algunos como una cirugía contaminada basándose fundamentalmente en estudios microbiológicos de la piel de la ingle, donde se han aislado gérmenes saprofitos que no frecuentan otras zonas del cuerpo humano. Este concepto unido al uso de la bioprótesis abrió las puertas al controversial concepto de profilaxis antibiótica en este tipo de intervenciones, independientemente de otros factores propios del paciente.
Más específicamente la relación de la infección con la CHBP radica en la posibilidad real de que una infección local pueda comprometer los planos profundos y llegar a afectar el bioimplante, considerándose esta, junto al rechazo del material, una de las más importantes complicaciones de este tipo de cirugía.
La incidencia de la infección del sitio operatorio (ISO) después de una herniorrafia inguinal primaria es del 1-2 %,13-15 pero la tasa de infección de la prótesis puede alcanzar hasta un 14 %.16 Según los criterios establecidos en la literatura médica, las ISO posterior a plastias ventrales e incisionales deben estar en rangos de 8 a 14 %,17 aceptados como "razonables para una buena práctica quirúrgica de este tipo de cirugía".
Contradictoriamente algunos trabajos han llegado a reportar que el riesgo de infección cuando se usa un bioimplante puede aumentar hasta un 6 %, argumentos como estos han hecho pensar en la colocación de prótesis como otro factor de riesgo. Si bien es cierto que durante la reacción inflamatoria inicial del organismo, previo a la incorporación del bioimplante, pueden producirse reacciones locales que faciliten la infección de este, sobre todo cuando se acompañan de la ISO, los autores no consideran al bioimplante como un factor de riesgo de infecciones, sino que conocer esta posibilidad debe servir para tener presente la necesidad de su manejo cuidadoso, con las más estrictas normas de asepsia y antisepsia.
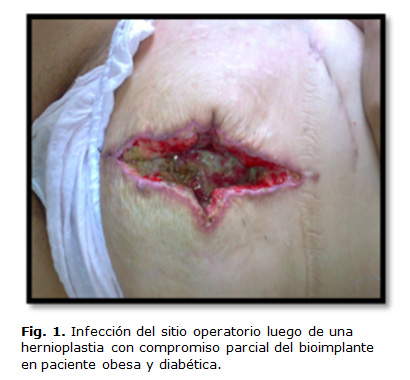
Desde el punto de vista epidemiológico los agentes más comúnmente asociados con la infección del bioimplante son el staphylococcus species (spp), streptococcus spp, los gérmenes gram-negativos (sobre todo enterobacterias) y bacterias anaerobias. Sin embargo, la tasa de infección de la bioprótesis se ve influenciada considerablemente por la comorbilidad subyacente en el paciente que la recibirá. En este grupo se pueden citar las enfermedades crónicas que presente el paciente y sus hábitos tóxicos (diabetes mellitus, malnutrición, enfermedad pulmonar obstructiva crónica, insuficiencia renal, inmunosupresión, obesidad mórbida, tabaquismo y abuso del alcohol) (Fig. 1), las que, entre otros factores, producen una reducción en la perfusión tisular de la piel y tejido subcutáneo, así como con una disminuida capacidad inmunosupresora.18
También influyen significativamente el tamaño de la incisión, el tipo de cirugía: electiva o urgente, así como, si esta última se asocia a otro proceder como la resección intestinal, rafias vesicales, entre otras.19 Pero tan importante como lo anterior es tener en cuenta el adecuado manejo de la prótesis bajo las más estrictas condiciones de asepsia, su transporte, almacenamiento y empaque.
A pesar de su importancia y vigencia, los reportes de este tipo de complicación son poco específicos. En esta región existen reportes de Chile, donde el Ministerio de Salud estableció en el 2005 una tasa nacional de 0,4 de las ISO en la reparación de la hernia inguinal electiva de adultos, sin especificar el uso o no de prótesis.20
En la susceptibilidad de las bioprótesis a infectarse o a responder mejor a su tratamiento juega un papel importante su diseño y composición, es ampliamente aceptado que existe un comportamiento distinto de las diferentes bioprótesis cuando han sido colonizadas por agentes patógenos.21 En las mallas microporosas pesadas es más fácil la retención de gérmenes y más difícil el acceso de macrófagos, así como con los biomateriales trenzados, aspecto este que dificulta su manejo en caso de infección. Por ello, en la actualidad se recomienda el uso de prótesis ligera de poro grande, nudo abierto y sencillo, fijada con sutura de monofilamento.22 De igual manera se ha demostrado la existencia de materiales más resistentes a la infección y que a su vez responden mejor al tratamiento, es el caso del polipropileno (PP), el cual comparado con el politetrafluoroetileno (PTFe), es más resistente y puede ser tratado exitosamente con altos niveles de curación sin la necesidad de extraer el bioimplante, aunque se asocia con múltiples complicaciones.
Factores a tener en cuenta durante la CHBP para reducir el riesgo de infección:
- Realización de una hemostasia exhaustiva durante el acto quirúrgico.
- Manejo cuidadoso del bioimplante bajo las más exhaustivas normas de esterilidad.
- Colocación del bioimplante en un plano profundo.
- Reparación herniaria de forma electiva y como proceder único.
- Poco tiempo quirúrgico.
- Evitar drenajes por tiempo prolongado.
- Uso de profilaxis antibiótica.
A pesar que aún no existe consenso sobre el uso de la profilaxis antibiótica en la CHBP, muchos cirujanos recomiendan su utilización, aunque existen consensos como la French Association of Anaesthesiology and Reanimation (SFAR), que no están de acuerdo con esta práctica rutinaria.
Manuel Sánchez y otros, en su metaanálisis sobre la profilaxis antibiótica en la CHBP, reporta una infección de la bioprótesis de un 1,4 % con profilaxis antibiótica y un 2,9 % sin esta.23
En la experiencia de los autores, el uso de cefazolina (bulbo: 1 g), en monodosis, como agente de profilaxis perioperatoria, demostró estar relacionado con bajas tasas de infección, por debajo del 1,3 %. Con criterios de uso a iguales dosis, se recomienda extender de mono, a doble o triple dosis en el posoperatorio de procederes con sangrado profuso, tiempo quirúrgico prolongado y comorbilidades, ya mencionadas anteriormente.
Tratamiento
Debemos ser cuidadosos ya que la presencia de una malla en las ISO no necesariamente implica su retirada inmediata si esta no está comprometida. El tratamiento local es de suma importancia y debe ir acompañado con antibióticos según antibiograma y cierre diferido, previo estudio microbiológico cuando se supere la infección. En muchos casos el cierre espontáneo se acompaña de fístulas, estas, una vez se controla la sepsis inicial, se pueden tratar en un segundo momento mediante fistulotomía y posible remoción de alguna porción de la malla no incorporada o material de sutura. Solo si persiste la infección de la malla o esta pasa a formar parte significativa del cuadro infeccioso podría evaluarse su extracción.
Las ISO con extensión o no a la malla deben ser tratadas mediante apertura, debridación amplia y lavado con solución salina fisiológica y drenaje (Fig. 2).
Las curas locales cuando existe ISO deben realizarse dos veces al día y de forma enérgica, ya que su fundamento no solo radica en la curación sino también en evitar la infección del bioimplante.
La infección del bioimplante es definido como una infección profunda que compromete la piel, el tejido celular subcutáneo, la fascia y/o el músculo.24 Su prevención y tratamiento es un verdadero reto en la actualidad, debido a los diferentes tipos de materiales y procederes, ya que la infección del bioimplante puede acompañarse de tasas de recidivas incluso más elevadas que las reparaciones tisulares,25 se ven asociadas a factores generales del paciente como el hábito de fumar, la obesidad, la diabetes y los tratamientos inmunosupresores.
La infección del bioimplante puede presentarse generalmente asociado a un absceso en la región donde se colocó y en ocasiones precedido de infección de la herida, también se pueden ver formando fístulas que drenan hacia el exterior (Fig. 3).
Para su tratamiento algunos autores recomiendan desde un inicio la completa remoción, acompañada o no del avance de un flapmiofacial.26-28 Sin embargo, una pobre evidencia y fundamento científico acompaña esta indicación de inicio, que sí se asocia a una elevada tasa de complicaciones derivadas de este, hasta 36, 3 %.29 Trunzo y otros y Aguilar y otros30,31 proponen el drenaje percutáneo del absceso mediante apertura parcial de la herida y tratamiento tópico mediante curas diarias como se explicó anteriormente; estos autores recomiendan además la instilación por el drenaje percutáneo de gentamicina 80 mg, 3 veces al día por 4 semanas, junto con antibiótico sistémico. Stremitzer y otros, proponen el uso de sistemas de aspiración al vacío (VAC, KCI Inc; San Antonio, TX).32
Según la experiencia de los autores en el tratamiento de este tipo de complicación, en un primer momento y dependiendo del estado de la infección, se recomienda tratamiento conservador del bioimplante, mediante el drenaje de abscesos y curas diarias de arrastre, 2 veces al día. Es necesaria la antibióticoterapia sistémica endovenosa, aun cuando no tengamos resultados de cultivos y antibiogramas, utilizando antibióticos efectivos contra el Staphylococcus en dependencia del mapa microbiológico de nuestras instituciones. Algunos autores recomiendan el uso combinado de ofloxacino y metronidazol, otros reportan el uso de la vancomycina con buenos resultados. Cuando la evolución es tórpida a pesar de lo anterior y persiste la infección o esta pasa a formar parte significativa del cuadro infeccioso, cabe entonces la posibilidad de evaluar la extracción parcial o total del bioimplante.
Bueno y otros, asocian la respuesta al tratamiento conservador con el tipo de malla implantada, reportando mejores resultados con mallas de polipropileno, con resultados satisfactorios hasta el 70 % de los casos, mientras que las mallas de politetrafluoroetileno (PTFE) tuvieron que ser extirpadas en todos los casos,16 argumento este que nos puede ayudar a elegir la prótesis y su tratamiento en caso de infección.
Como primer proceder y de manera conservadora, podría evaluarse la resección parcial del bioimplante, sobre todo la porción que no se ha logrado incorporar (Figs. 4 y 5), dejar para un segundo momento la extracción total si no quedase otra alternativa.
CONCLUSIONES
La infección de la malla es una complicación que necesita un tratamiento abarcador e intensivo y que incluye el control local de la infección, el uso de antibióticos y en ocasiones la remoción parcial o total del implante. El estudio de los factores de riesgo, las normas del uso y empaque, así como la técnica quirúrgica, son imprescindibles para evitar infecciones de la malla. El uso de la cefazolina como profilaxis antibiótica ha demostrado ventajas que la avalan, así como los antibióticos de amplio espectro para las infecciones instaladas. Las curas locales intensivas y en ocasiones las resecciones parciales del implante son alternativas válidas que reducen las comorbilidades asociadas a la infección del bioimplante.
REFERENCIAS BIBLIOGRÁFICAS
1. Grant AM. Open mesh versus nonmesh repair of groin hernia: Meta-analysis of randomized trials based on individual patient data. Hernia. 2002;6:130-6.
2. Jezupovs A, Mihelsons M. The analysis of infection after polypropylene mesh repair of abdominal wall hernia. World J Surg. 2006;30:2270-8.
3. Franneby U, Sandblom G, Nordin P. Risk factors for long-term pain after hernia surgery. Ann Sur. 2006;244:212-9.
4. Bay-Nielsen M, Kehlet H, Strand L. Quality assessment of 26 304 herniorraphies in Denmark: a prospective nationwide study. Lancet. 2001;358:1124-8.
5. Kald A, Nilsson E, Anderberg B, Bragmark M, Engström P, Gunnarsson U, et al. Reoperation as surrogate endpoint in hernia surgery. A three year follow-up of 1565 herniorrhapies. Eur J Surg. 1998;164;45-50.
6. Gilbert AI. Pitfalls and complications of inguinal hernia repair. En: Arregui ME, Nagan RF, editores. Inguinal hernia. Advances or controversies. Oxford-Nueva York: Radcliffe Medical Press; 1994. pp. 205- 211.
7. Hidalgo M, Higuero F, Álvarez-Caperochipi J, Machuca J, Laporte E, Figueroa J, et al. Hernias de la pared abdominal. Estudio multicéntrico epidemiológico (1993-1994). Cir Esp. 1996;59:399-405.
8. Susmallian S, Gewurtz G, Ezri T, Charuzi I. Seroma after laparoscopic repair of hernia with PTFE patch: is it really a complication? Hernia. 2001;5:139-41.
9. LeBlanc KA. Laparoscopic incisional and ventral repair: complications-how to avoid and handle. Hernia. 2004;8:323-31.
10. Cruse PJE. The epidemiology of wound infection. Surg Clin North AM. 1980;60:27-40.
11. Cruse PJE. Incidence of wound infection on the surgical services. Surg Clin NA. 1975;55:1269-75.
12. Bannura G, Guerra, JF, Salvado J. Infección de la herida operatoria en hernioplastia inguinal primaria. Rev Chil Cir. 2006;58:330-5.
13. Olson M, O'Connor M, Schwarz ML. Surgical wound infections.Ann Surg 1984; 199: 253-259.Bendavid R. Complications of groin hernia surgery. Surg Clin North Am. 1978;78:1089-103.
14. Deysine M. Pathophysiology, prevention and management of prosthetic infections in hernia surgery. Surg Clin North Am. 1998;78:1105-15.
15. Gilbert AI, Felton LL. Infection in inguinal hernia repair considering biomaterials and antibiotics. Surg Gynecol Obstet. 1993;117:126-30.
16. Bueno Lledo J, Sosa Quesada Y, Gómez Igavara I, Vásquez Urbaneja J, Carbonell Tatay F, Bonafe Diana S, et al. Infección de malla tras hernioplastia. 5 años de experiencia. Cir Esp. 2009;85:158-64.
17. Simchen E, Rozin R, Wax Y. The Israeli study of surgical infection of drains and the risk of infection in operations for hernia. Surg Gynecol Obstet. 1990;170:331-7.
18. Caínzos Fernández M. Infección de la herida operatoria en la cirugíalimpia. Valoración de la profilaxis antibiótica. Cir Esp. 1996;60:39-40.
19. Escartín A, Pellicer MM, Elía M, Jiménez A, Arribas MD, LagunasE et al. Profilaxis antibiótica en la cirugía de la hernia inguinal. Cir Esp. 1999;65:24-7.
20. Ministerio de Salud. Informe vigilancia epidemiológica de las infecciones intrahospitalarias. Chile: MINSAL; 2005.
21. Granell Vicent J. Prótesis de la pared abdominal e infección quirúrgica. Cir Esp. 1998;63:333-5.
22. Hidalgo Pascual M, Porrero Carro JL. Cirugía de las hernias inguinocrurales. Madrid: Monografía Asociación Española de Cirujanos. Sección de Pared Abdominal y Sutura; 1997.
23. French Association of Anaesthesiology and Reanimation (SFAR). Antibioprophylaxie en chirurgie et me´decine in-terventionnelle (patients adultes). Recommendations; 2010.
24. Sanchez-Manuel FJ, Seco-Gil JL. Antibiotic prophylaxis for hernia repair. Cochrane Database Syst Rev; 2009.
25. Aguilar B, Chapital AB, Harold KL. Conservative management of mesh-site infection in hernia repair. J Laparoendosc Adv Surg Tech A. 2010;20:249-52.
26. Delikoukos S, Tzovaras G, Liakou P, Mantzos F, Hatzitheo Wlou C () Late-onset deep mesh infection after inguinal hernia repair. Hernia. 2007;11:157.
27. Fawole AS, Chaparala RP, Ambrose NS. Fate of the inguinal hernia following removal of infected prosthetic mesh. Hernia. 2005:10:58-61.
28. Johanet H, Contival N. Deep mesh infection and cure of inguinal hernia. J Visc Surg. In press 2011.
29. Szczerba SR, Dumanian GA. Definitive surgical treatment of infected or exposed ventral hernia mesh. Ann Surg. 2003;237:437-41.
30. Aguilar B, Chapital AB, Harold KL. Conservative management of mesh-site infection in hernia repair. J Laparoendosc Adv Surg Tech A. 2010;20:249-52.
31. Trunzo JA, Ponsky JL, Jin J, Williams CP, Rosen MJ. A novel approach for salvaging infected prosthetic mesh after ventral hernia repair. Hernia 2009;13:54-9.
32. Stremitzer S, Bachleitner-Hofmann T, Gradl B, Gruenbeck M,Bachleitner-Hofmann B, Mittlboeck M, Bergmann M. Mesh graft infection following abdominal hernia repair: risk factor evaluation and strategies of mesh graft preservation. A retrospective analysis of 476 operations. World J Surg. 2010;34:1702-9.
Recibido: 5 de
marzo de 2014.
Aprobado: 7 de abril de 2014.
Eduardo José
Molina Fernández. Hospital Clínico Quirúrgico Comandante
Manuel Fajardo. Calle D entre Zapata y 29. Vedado. La Habana, Cuba.
Autor para
la correspondencia: Orlando de la Paz Mora. Correo electrónico:
orlandopm@infomed.sld.cu