PRESENTACIÓN DE CASOS
Pseudomixoma peritoneal avanzado por adenocarcinoma mucinoso de apéndice
Advanced pseudomyxoma peritonei caused by appendiceal mucinous adenocarcinoma
Dr. José Luis González González, Dr. Joaquín Menéndez Núñez, Dr. José Antonio Copo Jorge, Dra. Alba Abela Lazo
Grupo de Cirugía Hepatobiliopancreática. Servicio de Cirugía General, Hospital "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
El pseudomixoma peritoneal es una enfermedad de evolución recurrente y potencial maligno variable, caracterizada por ascitis gelatinosa disecante y, habitualmente, invasión peritoneal generalizada. Durante muchos años fue considerada una enfermedad intratable o incurable, y solo en las últimas décadas —y en centros muy especializados— se ha enfocado con un tratamiento radical y multimodal con miras a lograr la curación. Se presenta el caso de un varón de 43 años con un pseudomixoma de apéndice avanzado, que evolucionó bien después de un tratamiento agresivo.
Palabras clave: pseudomixoma, carcinosis peritoneal, peritonectomía.
ABSTRACT
Pseudomyxoma peritonei, a disease of recurrent progression with variable malignant potential, is characterized by pressing gelatinous ascytis and frequently by generalized peritoneal invasion. During many years, it was considered as untreatable and incurable disease; however, in the last few decades, very specialized centers have focused on the radical and multimodal treatment of this disease with a view to curing it. Here is the case of a 43 years-old patient with advanced appendicealpseudomyxoma that recovered well after an aggressive treatment.
Keywords: pseudomyxoma, peritoneal carcinosis, peritonectomy.
INTRODUCCIÓN
El pseudomixoma peritoneal es una enfermedad de evolución recurrente, y a menudo fatal, que se caracteriza por ascitis gelatinosa disecante e implantes multifocales en el peritoneo, los cuales están constituidos por abundantes glóbulos de mucina intracelular.1, 2 Este síndrome, descrito por Rokitansky en 1842, es más habitual en las mujeres de edad media o avanzada, y su origen más frecuente es el apéndice, seguido por el ovario, el páncreas, los intestinos, las vías biliares y el uraco. Su incidencia es de 2 casos por 10 000 laparotomías.3
La diseminación peritoneal constituye uno de los principales patrones de recaída tras la cirugía en los tumores de localización abdominal y pélvica. Ha sido considerada clásicamente como un signo de enfermedad generalizada, que se trata de forma paliativa y que tiene un desenlace inevitablemente fatal.
La diseminación de las células tumorales en el peritoneo puede ser espontánea o producirse durante la cirugía, por mecanismos como la formación de émbolos tumorales por presión, la fuga de células malignas al cortar los vasos linfáticos o la siembra de estas en la cavidad peritoneal durante la disección quirúrgica. Va seguida habitualmente de la invasión o perforación de la serosa.
Una vez extirpado el tumor primario, los factores de crecimiento celular involucrados en la cicatrización estimulan el crecimiento de las células malignas viables atrapadas o en coágulos sanguíneos intraabdominales, o por la fibrina en las superficies peritoneales traumatizadas. Paralelamente, el atrapamiento de dichas células dificulta el acceso a ellas con la quimioterapia sistémica, lo cual disminuye o anula la eficacia de esta última.4
Estos tumores apendiculares son de potencial maligno variable —desde adenomas hasta adenocarcinomas—, y tienen un comportamiento distinto al del resto de las neoplasias gastrointestinales. Biológicamente son poco agresivos, tienden a recubrir la superficie peritoneal más que a penetrar en los tejidos, y no suelen metastatizar ni producir afectación ganglionar. Se diseminan al peritoneo en estadios tempranos de la enfermedad debido a una ruptura en la pared del apéndice. La siembra peritoneal se distribuye de forma característica en lugares donde se reabsorbe el líquido ascítico (cara abdominal del hemidiafragma derecho, omentos mayor y menor, espacios retrohepático e infrahepático derechos y pelvis), y no afecta las superficies peritoneales con mayor actividad peristáltica, como el intestino delgado y, en menor medida, el estómago.
Aunque la histología sea de bajo potencial maligno, son neoplasias incurables e inevitablemente fatales si se las deja sin tratamiento. Su historia natural se caracteriza por un crecimiento lento y progresivo que produce compresión de las estructuras abdominales, por lo que la mayoría de los enfermos fallece por obstrucción intestinal.5
El análisis de diversas series de pacientes tratados con cirugía ha permitido identificar la calidad de la cirugía como otro factor pronóstico de primer orden, independiente de la histología. Con una citorreducción óptima, entendida como tal la ausencia de tumor o la presencia de implantes menores de 2,5 cm, independientemente de su número y localización, la mediana de supervivencia a los 5 años está en torno al 80 %, mientras que si la citorreducción no es adecuada, esta no supera el 20 %.
Desde 1980 han aparecido en la bibliografía nuevas propuestas para el tratamiento de los pacientes afectos de diseminación tumoral peritoneal, un grupo de difícil manejo terapéutico y emocional, derivado de la perspectiva de fracaso terapéutico y en el que ha ocurrido una pérdida rápida y progresiva de la calidad de vida. La administración de fármacos antitumorales por vía intraperitoneal, la inmunoterapia intracavitaria, la terapia fotodinámica o la quimioterapia e hipertermia intraperitoneal constituyen una muestra de las líneas de trabajo en esta dirección.
La perfusión intraperitoneal con quimioterapia e hipertermia ha ofrecido hasta el momento resultados esperanzadores. Consiste en realizar la cirugía de exéresis máxima o debulking, seguida de dosis altas de quimioterapia regional en perfusión hipertérmica durante el mismo acto operatorio. En ocasiones, la técnica se completa con la administración de dosis altas de quimioterapia en la cavidad peritoneal durante los días posteriores a la cirugía, a través de catéteres provisionales implantados a tal efecto. La cirugía posibilita la reducción de la enfermedad peritoneal a un tamaño mínimo y libera todas las adherencias, con lo que crea condiciones óptimas para lograr mayor eficacia de los citostáticos. Estos son potenciados por el calor, que por sí mismo también tiene un efecto citotóxico, se elimina el atrapamiento celular, y se consiguen altas concentraciones del fármaco en la zona que se desea tratar, imposibles de lograr por vía sistémica debido a su toxicidad.6-8
PRESENTACIÓN DEL CASO
El paciente es un varón de la raza blanca, de 43 años de edad, que desde otra provincia acude al hospital remitido con diagnóstico de "ascitis" por posible hepatopatía. Refiere antecedentes patológicos de hepatitis —aunque no conoce la variedad— cuando era más joven. Niega cirugías previas u otro padecimiento. Menciona que desde hace aproximadamente 5 meses viene presentando decaimiento, pérdida de peso, plenitud gástrica, aumento del diámetro abdominal y dolor hacia el hemiabdomen inferior.
Ingresa en el servicio de medicina interna, donde se completa su estudio y se encuentra:
Con todos estos elementos clínicos y los estudios realizados se realizó una discusión colectiva con los servicios de medicina interna, oncología y cirugía, por tratarse de un paciente con una enfermedad avanzada y con un pronóstico pobre. Se decidió su intervención quirúrgica con el ánimo de lograr una citorreducción máxima, para posteriormente aplicar ciclos de quimioterapia sistémica.
Intervención quirúrgica
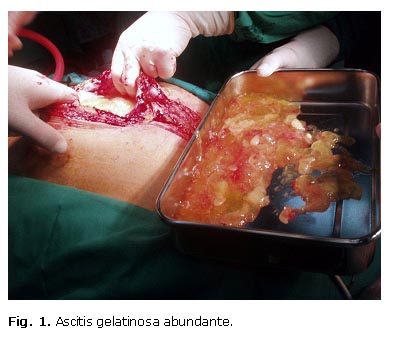
Se realizó una amplia incisión xifopubiana y se encontró inmediatamente una gran cantidad de mucina amarillenta muy adherente y densa, de unos 5 a 6 L, que fue necesario extraer manualmente (Fig. 1). Luego se halló una gran coraza tumoral, friable, que bloqueaba el acceso al intestino —se trataba del epiplón mayor—, y un peritoneo parietal francamente engrosado y tumoral.
Esta gran masa, de aproximadamente 20 cm de diámetro por unos 10 cm de grosor, pudo ser separada fácilmente del intestino delgado, prácticamente indemne, mediante una disección roma y digital. Fue ligada toda la irrigación que llegaba a ella a través de los vasos epiploicos francamente hipertróficos (Fig. 2).
Se continuó la disección hasta lograr liberar la tumoración de todo el colon transverso y el ángulo esplénico, y se extrajo la gran masa, en bloque, con el bazo completamente incluido en el proceso. Se resecó entonces toda la masa tumoral, que englobaba el antro pilórico y el epiplón menor.
Se comprobó la existencia de un ciego y un apéndice totalmente tumorales, y se realizó una hemicolectomía derecha con ileotranversostomía y sutura manual en un plano. Se practicó una peritonectomía parietal abdominal, diafragmática y pélvica, y se aplicó una electroevaporación parcial de la cápsula de Glisson y el mesenterio (Fig. 3).
Se disecó el hilio hepático, y se logró resecar una cantidad abundante de la tumoración. Se realizó una colecistectomía y se disecó el retroperitoneo (exponiendo los grandes vasos: cava, aorta, vasos renales hasta los vasos ilíacos), sin adenopatías. Se identificaron los vasos gonadales y ambos uréteres. Se colocaron dos drenajes de silicona núm. 32 y se cerró la pared abdominal, con lo cual concluyó la intervención quirúrgica. Se extrajo en total 13 kg de tumor y mucina.
El paciente evolucionó favorablemente, sin complicaciones, y recibió el alta hospitalaria al quinto día posoperatorio para comenzar la quimioterapia sistémica. Después de 18 meses de seguimiento se encuentra asintomático y libre de recidiva.
DISCUSIÓN
El conocimiento actual acerca de las neoplasias apendiculares mucinosas (NAM) y su diseminación peritoneal es amplio y bien fundamentado. Para ello han sido claves las aportaciones de cirujanos como Paul H. Sugarbaker.9 Numerosos estudios y consensos avalan la cirugía citorreductora completa combinada con quimioterapia intraperitoneal transoperatoria como el tratamiento de elección en la actualidad contra las NAM con diseminación peritoneal.10-18
La consideración de que se trata de neoplasias no invasivas, que quedan limitadas en la cavidad abdominal y que se distribuyen de una forma característica que permite resecciones completas sin comorbilidad excesiva (el intestino delgado raramente está afecto), ha llevado a muchos autores a considerar que el objetivo de este tratamiento puede ser curativo, y no paliativo como antaño.5
Sucede que los recursos necesarios para llevar a cabo esta cirugía combinada —y, específicamente, la implementación de la quimioterapia intraoperatoria hipertérmica— son costosos y no están aún a nuestro alcance. No obstante, es consenso general que el esfuerzo quirúrgico, la resección tumoral radical o con la mayor radicalidad posible son los elementos más valiosos para poder esperar una mayor sobrevida en estos pacientes. Sin ellos ningún tipo de tratamiento adyuvante podría tener algún beneficio.
REFERENCIAS BIBLIOGRÁFICAS
1. Zapata E, Cosme A, Poch M, Fernández J, Ojeda E. Seudomixoma peritoneal. Diagnóstico mediante técnicas de imagen. Sistema. 2009;39(90).
2. O'Connell JT, Tomlinson JS, Roberts AA, McGonigle KF,Barsky SH. Pseudomyxoma peritonei is a disease of MUC2-expressing goblet cells. Am J Pathol. 2002;161:551-64.
3. Lersch C, Frimberger E, Ott R, Classen M. Gray-scale sonographic findings in a patient with pseudomyxoma peritonei. J Clin Ultrasound. 2001;29:186-91
4. Farré Alegre P,Bretcha B, Martín ML, Sureda M, Brugarolas A. Carcinomatosis peritoneal. Quimioterapia intraperitoneal con hipertermia. Oncología. 2004;27(4):262-6.
5. Guerrero A, et al.Carcinomatosis peritoneal por tumor apendicular. Oncología. 2005;28(4):197-201.
6. Glehen O, et al. Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study. J Clin Oncol. 2003;21(5):799-806.
7. Verwall V, van Ruth S, de Bree E, van Slooten W, van Tinteren H. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol. 2003;21:3737-43.
8. Sugarbaker PH, Chang D. Results of treatment of 385 patients with peritoneal surface spread of appendiceal malignancy. Ann SurgOncol. 1999;6:727-31.
9. Sugarbaker PH. Epithelial appendiceal neoplasms. Cancer J. 2009;15:225-35.
10. Yan TD, Black D, Savady R, Sugarbaker PH. A systematic review on the efficacy of cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxomaperitonei. Ann Surg Oncol. 2007;14: 484-92.
11. Sugarbaker PH. New standard of care for appendiceal epithelial neoplasms and pseudomyxomaperitonei syndrome? Lancet Oncol. 2006;7:69-76.
12. GonzálezMoreno S. Cirugía citorreductora y quimioterapia intraperitoneal perioperatoria para las neoplasias con diseminación peritoneal: ha llegado el momento. Cir Esp. 2005;78:341-3.
13. González Moreno S, Bretcha Boix P, Rufián Peña S, Cristóbal Muñoz Casares F. Conceptos importantes sobre el tratamiento de las neoplasiasapendiculares mucinosas y del seudomixoma peritoneal. Cirugía Española. 2011;89(3):200-2.
14. Foster JM, Gupta PK, Carreau JH, Grotz TE, Blas JV, Gatalica Z, Loggie BW. Right hemicolectomy is not routinely indicated in pseudomyxoma peritonei. The American surgeon. 2012;78(2):171-7.
15. Andréasson H, Graf W, Nygren P, Glimelius B, Mahteme H. Outcome differences between debulking surgery and cytoreductive surgery in patients with pseudomyxoma peritonei. European Journal of Surgical Oncology (EJSO). 2012;38(10):962-8.
16. Cole KL, Choudry HA, Jones HL, Goodell PP, Bartlett DL. Critical role of hyperthermic intraperitoneal chemoperfusion in the treatment of a patient with Pseudomyxoma peritonei. Journal of Surgical Oncology. 2012;106(4):513-6.
17. Carr NJ, Finch J, Ilesley IC, Chandrakumaran K, Mohamed F, Mirnezami A, Moran B. Pathology and prognosis in pseudomyxomaperitonei: a review of 274 cases. Journal of Clinical Pathology. 2012;65(10):919-23.
18. Chua TC, Moran BJ, Sugarbaker PH, Levine EA, Glehen O, Gilly FN, Morris DL. Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Journal of Clinical Oncology. 2012;30(20):2449-56.
Recibido: 23 de abril de 2013.
Dr. José Luis González González. Grupo de Cirugía Hepatobiliopancreática. Servicio de Cirugía General, Hospital "Hermanos Ameijeiras". Calle Padre Varela y San Lázaro, Centro Habana. La Habana, Cuba. Correo electrónico: joseluis@infomed.sld.cu